Actualmente para la comunidad científica la existencia de moléculas es innegable, de hecho el estudio microscópico de la materia es ahora una de las mejores formas de comprender fenómenos macroscópicos, pues fenómenos tales como los eléctricos y termodinámicos pueden reducirse, a partir del estudio del comportamiento atómico\molecular, a simples mecanismos mecánicos. Trabajos como los de Lavoiser, Proust, Dalton,Gay Lussac hacia finales del siglo XVIII, y posteriormente los trabajos de Boltzmann, Clausius, Einstein, entre otros, consolidaron la Teoría atómico\molecular de la materia, una teoría muy elegante y que fue revolucionada de la mano de Planck, Bohr y otros ambiciosos físicos a lo que hoy conocemos como Mecánica Cuántica. Sin embargo, para el siguiente documento nos centraremos en el movimiento molecular, que luego nos abrirá campo para hablar de Termodinámica.
Una de la características fundamentales de las moléculas, es la fuerza que describe su interacción con otra molécula vecina. Las fuerzas intermoleculares que mantienen unidas las moléculas en un líquido o en un sólido son principalmente de naturaleza eléctrica, las cuales provienen de las interacciones eléctricas entre las partículas fundamentales de las cuales están compuestas las moléculas. Sin embargo, las moléculas no cumplen la sencilla ley del inverso al cuadrado, pues la interacción gravitatoria entre éstas es insignificante comparada con las interacciones eléctricas.
Cuando las moléculas están alejadas, como en un gas, las fuerzas intermoleculares son muy pequeñas, pero, cuando éste se comprime, la fuerza aumenta, hasta tal punto en que las moléculas de un gas puedan conformar un líquido, y estas un sólido (bajo unas extremas condiciones, obviamente). Así pues, la fuerza ha de variar algo con la distancia r (¿no es así?). A distancias grandes, la fuerza es pequeña y atractiva. Cuando las moléculas se aproximan, la fuerza de atracción se hace cada vez mayor, pasa por un máximo y disminuye luego hasta 0 a una distancia de equilibro r0. Cuando la distancia es menor que r0 la fuerza se hace repulsiva y aumenta rápidamente. En la figura, vemos la energía potencial en función de r; la energía potencial tiene su mínimo en r0, donde la fuerza es nula. Una función de energía potencial de este tipo se denomina a menudo pozo de potencial.
Si las fuerzas moleculares son atractivas, ¿porque no acaban de unirse todas las moléculas de la materia en fase líquida y sólida? La respuesta es que las moléculas están en continuo movimiento y por tanto tienen energía cinética. Esto es, la energía cinética tiene una proporción directa con la temperatura, es decir si la energía cinética de las moléculas aumenta, la temperatura también lo hará. A temperaturas muy bajas, la energía cinética media de una molécula puede llegar a ser mucho menor que el valor máximo de la energía potencial, la profundidad del pozo de potencial. Por lo tanto, las moléculas se condensan en estado líquidos y sólidos con una separación intermolecular media aproximada a r0. A temperaturas muy elevadas, la energía cinética de las moléculas aumenta, hasta poder llegar a escapar de la fuerza intermolecular, pues la energía cinética media se hace mayor que la profundidad del pozo de potencial.
En los sólidos, las moléculas ejecutan un movimiento vibratorio en torno a centros fijos. Si la forma del pozo de potencial es parabólico en las proximidades de su mínimo, las moléculas describen un movimiento Armónico Simple. Los centros fijos están contenidos en una red espacial que origina la extraordinaria regularidad y simetría de los cristales. En los líquidos, las distancias medias intermoleculares son un poco mayores que en el caso de los sólidos, con esto las moléculas, que giran alrededor de unos centros no tan fijos, tienen mayor energía que en el sólidos. Los líquidos sólo muestran cierta cierta estructura regular en la inmediata vecindad de algunas moléculas. A esto lo denominamos orden de corto alcance, en contraste con el orden de largo alcance de un sólido cristalino..
En el caso de las moléculas de un gas, estas tienen mayor energía cinética que en los sólido y líquidos pues son libres en sus movimientos, ya que sus fuerzas intermoleculares son despreciables, por tanto su distancia media (entre las moléculas) es mucho mayor en los sólidos y líquidos. Por esto, una molécula de gas, describe un movimiento rectilíneo, hasta que cambia de dirección al chocar con otra molécula o con una pared de un recipiente que lo contiene. Por teoría, en un gas ideal las fuerzas intermoleculares no existen.
Número de Avogadro.
Los trabajos de Gay-Lussac y el padre de la química moderna Jhon Dalton, fueron de gran relevancia en lo que mas tarde un químico contemporáneo de Dalton, Amadeo Avogadro, formularía como el número de Avogadro. Estos trabajos, hacia 1811, conformaban, junto con los realizados por Lavoiser y Proust, las verificaciones experimentales de la existencia de los átomos (luego hablaremos de estos trabajos). John Dalton fue el primero en sugerir que todas las moléculas de una sustancia química determinada son semejantes, esto era respaldado por los resultados experimentales de Gay-Lussac, en los que se confirmaba que iguales volúmenes de gases a la misma temperatura y presión contienen igual número de átomos. Esta hipótesis, facilita la comprensión de por qué, en las reacciones químicas los compuestos se combinan entre sí en proporciones definidas por la masa (ley de la conservación de la materia-Lavoiser). Esto a su ves lleva a conceptos como masa molecular y número de moles. Un mol, de cualquier compuesto químico puro contiene un número definido de moléculas, el mismo para todos los compuestos. El número de moléculas es lo que conocemos como Número de Avogadro (NA).
Uno de los primeros intentos de obtener este número, consistió en esparcir una gota de aceite en una superficie de agua. Suponiendo que el aceite sigue esparciéndose hasta que la capa alcanza el espesor de una molécula, y no puede esparcirse más, puede estimarse el volumen de una única molécula. Actualmente, se han llevado a cabo mediciones más precisas con rayos X.
El valor NA más aceptado es:
Número de Avogadro.
Los trabajos de Gay-Lussac y el padre de la química moderna Jhon Dalton, fueron de gran relevancia en lo que mas tarde un químico contemporáneo de Dalton, Amadeo Avogadro, formularía como el número de Avogadro. Estos trabajos, hacia 1811, conformaban, junto con los realizados por Lavoiser y Proust, las verificaciones experimentales de la existencia de los átomos (luego hablaremos de estos trabajos). John Dalton fue el primero en sugerir que todas las moléculas de una sustancia química determinada son semejantes, esto era respaldado por los resultados experimentales de Gay-Lussac, en los que se confirmaba que iguales volúmenes de gases a la misma temperatura y presión contienen igual número de átomos. Esta hipótesis, facilita la comprensión de por qué, en las reacciones químicas los compuestos se combinan entre sí en proporciones definidas por la masa (ley de la conservación de la materia-Lavoiser). Esto a su ves lleva a conceptos como masa molecular y número de moles. Un mol, de cualquier compuesto químico puro contiene un número definido de moléculas, el mismo para todos los compuestos. El número de moléculas es lo que conocemos como Número de Avogadro (NA).
Uno de los primeros intentos de obtener este número, consistió en esparcir una gota de aceite en una superficie de agua. Suponiendo que el aceite sigue esparciéndose hasta que la capa alcanza el espesor de una molécula, y no puede esparcirse más, puede estimarse el volumen de una única molécula. Actualmente, se han llevado a cabo mediciones más precisas con rayos X.
El valor NA más aceptado es:
La masa molecular M de un compuesto es
donde NA es el número de Avogadro y m la masa de una sola molécula.
¿Moléculas y George Washington?
Los números de una magnitud tan grande son muy difíciles de comprender. Sir James Jeans eminente astrofísico británico dio una explicación para esto. Cada movimiento respiratorio humano es de 400cm3, de esto deducimos que es por tanto de unas 10^22 moléculas. Supongamos el último suspiro de George Washington se halla distribuido uniformemente por toda la atmósfera, que según estimó Jeans contiene 10^44 moléculas. Por tanto el número de moléculas que contiene una respiración es prácticamente igual al número de moléculas en la atmósfera, y como el volumen total de los pulmones( entre 2000 y 3000cm3) es varias veces el volumen de una respiración , cada uno de nosotros en sus pulmones, probablemente, tenga varias moléculas del último suspiro de George Washington.
Propiedades moleculares de la materia.
Ya hemos mencionado que el estudio molecular es de gran utilidad para comprender fenómenos macroscópicos. Por ejemplo, si proponemos que las "partículas" no son sólo puntos geométricos, sino que tienen un tamaño finito, se pueden comprender propiedades tales como la viscosidad, conductividad térmica y coeficiente de difusión de un gas, además, suponiendo que existen fuerzas entre las partículas, es posible lograr que la ecuación de estado de un gas ideal, coincida mejor con la ecuación de estado de un gas real, y poder explicar fenómenos como la licuefacción y solidificación a bajas temperaturas, también se pueden comprender cuestiones tales como porque los gases poliatómicos tienen mayor capacidad calorífica a volumen constante que los monoatómicos. Las propiedades eléctricas y magnéticas de la materia, la emisión y la absorción de la luz, exigen un modelo molecular formado por un conjunto de partículas subatómicas, estas partículas son el origen de las fuerzas intermoleculares.
Propiedades moleculares de la materia.
Ya hemos mencionado que el estudio molecular es de gran utilidad para comprender fenómenos macroscópicos. Por ejemplo, si proponemos que las "partículas" no son sólo puntos geométricos, sino que tienen un tamaño finito, se pueden comprender propiedades tales como la viscosidad, conductividad térmica y coeficiente de difusión de un gas, además, suponiendo que existen fuerzas entre las partículas, es posible lograr que la ecuación de estado de un gas ideal, coincida mejor con la ecuación de estado de un gas real, y poder explicar fenómenos como la licuefacción y solidificación a bajas temperaturas, también se pueden comprender cuestiones tales como porque los gases poliatómicos tienen mayor capacidad calorífica a volumen constante que los monoatómicos. Las propiedades eléctricas y magnéticas de la materia, la emisión y la absorción de la luz, exigen un modelo molecular formado por un conjunto de partículas subatómicas, estas partículas son el origen de las fuerzas intermoleculares.


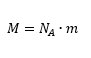
No hay comentarios:
Publicar un comentario