Ahora ya conocidos el equilibrio mecánico y el químico, nos preguntamos ¿están relacionados estos equilibrios con el equilibrio térmico? Claramente hay una relación, pues un equilibrio térmico existe cuando no hay cambios en las variables de un sistema en equilibrio mecánico y químico, esto cuando están aislados del medio por una pared diatermana. En un equilibrio térmico todas las partes de un sistema se encuentran a la misma temperatura,y esta temperatura es igual a la del medio ambiente. Si estas condiciones no se cumplen, tendrá lugar un cambio de estado hasta alcanzar el equilibrio térmico. En el caso de que las condiciones necesarias para los tres tipos de equilibrio se satisfagan, se dice que el sistema se encuentra en equilibrio termodinámico. en este estado es evidente que no habrá tendencia a algún cambio de estado, ni en el sistema ni en el medio exterior. Los estados de equilibrio termodinámico pueden definirse en función de variables macroscópicas en las que no intervenga el tiempo, es decir, en función de variables termodinámicas. Esto es debido a que la termodinámica no se involucra en problemas relacionados con velocidades de procesos, esto es objeto de estudio de ramas como la teoría cinética de los gases, la hidrodinámica, etc. En el caso de que no exista este equilibrio, habrán fuerzas entre el sistema y el medio, las cuales causaran fenómenos como la turbulencia, remolinos, ondas, etc. También, se encuentra que la presión varía de una parte del sistema a otra por tanto no existe una presión única en el sistema, de igual forma cuando existe diferencia de temperatura entre el sistema y el medio, se establece una distribución de temperatura no uniforme y no hay una temperatura única que corresponda a todo el sistema. De esto deducimos que si no se cumplen las condiciones del equilibrio mecánico y térmico, los estados por los cuales pasa el sistema no pueden definirse en función de variables termodinámicas que se refieran al sistema en conjunto.
Ecuación de estado.
Todos sistema termodinámico posee una ecuación de estado, aunque en algunos casos puede resultar matemáticamente complejo describir uno de ellos. Una ecuación de estado representa las peculiaridades individuales de un sistema en contraste con otro, y por consiguiente ha determinarse mediante la experimentación o por una teoría molecular. Esto resulta así, pues por si por ejemplo tenemos una masa de un gas, a un determinado volumen, y a una cierta temperatura, el valor de la presión quedará determinado por la misma Naturaleza. Es decir de las tres variables termodinámicas hay dos independientes.
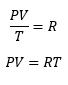 |
| (1) y (2) |
 |
| (3) para presiones muy altas. |
Es evidente que no existe una ecuación de estado para aquellos sistemas en los que no existe el equilibrio mecánico y térmico, pues no hay manera de describirlos en función de variables termodinámicas. De modo de ejemplo, imaginemos un gas encerrado en un cilindro provisto de un pistón, y que además el gas se expande y comunica al pistón un movimiento acelerado. En este caso, no es posible hallar la presión del gas por medio de una ecuación de estado, pues esta dejaría de ser una variable termodinámica debido a que dependería de la velocidad y de la aceleración del pistón.
No hay comentarios:
Publicar un comentario