James Prescott Joule, influenciado por los trabajos del Conde Rumford, quien había descubierto que la fricción generaba calor, desarrolló una máquina con el objetivo de determinar el equivalente mecánico del calor.
Joule dispuso un recipiente aislado térmicamente, provisto de unas paletas dentro del mismo, las cuales están conectadas a una cuerda con una masa que puede caer. Conforme la masa cae, las paletas giran, agitando así el agua, empleando la energía potencial gravitacional de la masa para hacer que estas giren. Debido a este giro, el agua aumenta de temperatura.
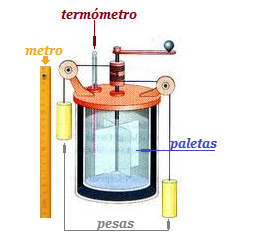
Una masa m desciende una altura h, su energía potencial gravitacional vendría dada por
Esta es la energía que luego se convertirá en calor, el cual viene dado por
De la mecánica conocemos la conservación de la energía, en la cual igualábamos, por ejemplo, la energía potencial gravitacional con la energía cinética de un objeto que cae. Sin embrago, ¿ a donde va la energía cuando el objeto cae?¿si se conserva no debería volver a subir el objeto? La respuesta es que la energía se convierte en energía térmica, así pues, cuando un objeto cae a una superficie, la superficie se calienta. Es decir, debemos en este caso igualar la energía potencial gravitacional con la energía térmica que produce, tenemos entonces
Despejando la constante c tenemos:
Joule encontró que la disminución de la energía potencial es proporcional al incremento de la temperatura del agua. La constante de proporcionalidad, que es el calor específico del agua es 4,186 J/g℃, esto quiere decir que 4,186 J aumentan la temperatura de 1g de agua a 1℃.
1Cal=4,186 J
Calor y trabajo
Hemos visto que el calor es la energía que pasa de un cuerpo a otro debido a una diferencia de temperaturas entre ellos. Pues la idea del calórico, la sustancia que hay dentro de un cuerpo contradice muchos hechos experimentales. Si el calor fuera una sustancia, o una clase de energía que un sistema contiene, no seria posible extraer calor indefinidamente de un sistema que no cambia. Conde Rumford demostró que si era posible, poniendo a trabajar el dispositivo de Joule continuamente, podemos obtener del agua una cantidad indefinida de calor. El trabajo, análogamente no es algo que un sistema contenga en una cantidad definida. Podemos realizar una cantidad indefinida de trabajo a un sistema sin cambiar sus condiciones, como bien lo ilustra el aparato de Joule. El trabajo al igual que el calor, requiere una transmisión de energía.
Sabemos de la mecánica, que una diferencia de energía implicaba un trabajo, en estas variaciones de energía la temperatura no jugaba ningún papel. Si la energía calorífica se transmite por diferencias temperatura, podemos distinguir entre el calor y el trabajo, definiendo a este último como la energía que se transmite de un sistema a otro de tal manera que no interviene directamente una diferencia de temperaturas. Esto en la expresión W=f dx, la fuerza f puede provenir de fuentes eléctricas, magnéticas, gravitacionales, u otras. El término trabajo incluye todos esos procesos de transformaciones de energía, pero específicamente excluye transformaciones de energía que provengan de diferencias de temperaturas.
Por ejemplo, frotarse las manos o frotar dos superficies. No hay Límites a la cantidad de calor que puede extraerse del sistema o la cantidad de calor que puede proporcionársele, de modo que no tienen un significado preciso frases como "el calor contenido en el sistema" o "el trabajo en el sistema". Las cantidades Q y W no están asociadas con el sistema sino con el proceso de interacción del sistema con su entorno, es decir, sólo mediante la interacción se puede dar un significado al calor y al trabajo. Podemos entonces identificar en forma definida a Q como el calor comunicado al sistema o extraído de él, y a W como el trabajo hecho sobre e sistema o efectuado por él.
En la figura se observa un dispositivo, el cual consiste en dejar caer un peso el cual echa andar un generador, que a su vez manda una corriente eléctrica a una resistencia colocada en el recipiente con agua. Consideremos como un sistema a al circuito eléctrico, el agua y su recipiente; entonces el estado del sistema cambiará, y la razón es el trabajo externo realizado sobre el sistema por el peso que cae. Aquí no intervienen diferencias de temperaturas. Pero suponiendo ahora que el sistema es el agua y el recipiente, y por tanto, el ambiente es el circuito y el peso que cae, entonces debido a la diferencia de temperatura entre la resistencia y el agua, hay un flujo de calor del ambiente al sistema, en este caso no se hace directamente trabajo sobre el sistema. Por consiguiente debe ser claro que se debe elegir antes el sistema y cual es el ambiente, antes de establecer si el cambio en el sistema se deba a un flujo de calor o a la realización de trabajo. Habrá una transferencia de calor entre le sistema y su ambiente sólo cuando haya una diferencia de temperaturas, en caso de que esto no suceda, debe estar implicado la realización de trabajo.





No hay comentarios:
Publicar un comentario